Le Chatelier Prensibi ve Kimyasal Denge
21 Aralık 2014 Pazar
Le Chatelier Prensibi
Henry Louis Le Chatelier'i Tanıyalım
Henry Louis Le Chatelier fransız kimyacısı ve maden bilim adamıdır. (Paris 1850-Miribale-les - Echelles, Isere 1936). Mühendis Louis Le Chatelier’nin oğludur. Birincilikle girdiği Ficole Polytechnique’i gene birincilikle bitirerek, maden mühendisi olmuştur . Kimya üstüne araştırmalar yapmış ve kimya dersleri vermiştir. Ecole Polytechnique’te belletici , Maden okulunda Sınaî kimya profesörü olmuştur ve 1898’de College de France’da maden kimyası kürsüsünün başına geçmiştir.
Le Chatelier Prensibi
Dengede olan bir sistem, reaktif ve ürünlerin derişimlerinde ki değişmeler ile sıcaklık ve basınç değişmelerinden etkilenir. Sistemde denge tekrar kuruluncaya kadar reaksiyon, ileri ya da geri yönde tekrar başlar. Dengeye etki eden faktörler şunlardır:
- Derişim Etkisi
- Basınç Etkisi
- Sıcaklık Etkisi
- Katalizör Etkisi
Le Chatelier'e göre: "Bir sisteme dışarıdan bir etki yapılırsa sistem bu etkiyi azaltacak yönde tepki gösterir" İşte bu Le Chatelier prensibidir.
Dengeye Etki Eden Faktörler
1.Derişimin Etkisi
Denge hâlindeki bir sisteme reaktif veya ürünlerden biri ilâve edilirse, o maddenin derişimi artar. Denge bu maddeyi ve etkisini azaltacak yönde sağa ya da sola bozulur. Madde ilâvesi reaksiyon denkleminin hangi tarafına yapılmış ise, o tarafın hızı artar. Ancak bir süre sonra ileri ve geri yöndeki reaksiyon hızlan eşitlenerek yeni denge kurulur. Bununla birlikte derişim değişikliğinin denge sabitinin sayısal değerine etkisi yoktur. Yani denge sabiti Kc'nin sayısal değeri değişmez.
2. Basıncın Etkisi
Denge sisteminde maddelerin gaz hâlinde olması durumunda, reaksiyon kabının hacmi(basıncı) değiştirilerek sistemdeki tüm maddelerin derişimi değiştirilebilir. Denklemi ile verilen reaksiyonun söz konusu olduğu bir sistemde sistemin hacmini yarıya indirelim. Bu durumda basıncın iki katına çıkması gerekir. Ancak Le Chatelier prensibi gereğince sistem, basıncı azaltacak şekilde tepki gösterir. Bunun için reaksiyon, denge hâlinde bulunan maddelerin mol sayısının az olduğu yöne kayar.
3. Sıcaklığın Etkisi
Kimyasal reaksiyonlarda sıcaklık değişimi, hem dengeyi, hem de denge sabitinin sayısal değerini değiştirir. Sıcaklık etkisiyle dengenin hangi yönde bozulacağı, reaksiyonun endotermik ya da ekzotermik oluşuna bağlıdır.
Ekzotermik Tepkimelerde: Denge girenlere kayar.
Endotermik Tepkimelerde: Denge ürünlere kayar.
4. Katalizörün Etkisi
Denge tepkimesinde katalizör kullanılırsa katalizör ileri ve geri yöndeki aktifleşme enerjilerini aynı oranda azaltarak denge halini etkilemez ve denge sabiti Kc'yi değiştirmez.
16 Aralık 2014 Salı
Kimyasal Denge Hakkında
Kimyasal Denge Nedir?
Kimyasal denge iki yönlü bir tepkime de ürünlerin meydana geliş hızının, ürünlerden tekrar tepkimeye girenlerin meydana geliş hızına eşit olduğu durumdur. Böyle denklemlerde tepkimenin her iki tarafa olabileceğini göstermek için çift yönlü ok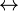 kullanılır.
kullanılır.Denge Sabiti Kc Nasıl Hesaplanır?
Denge sabiti (Kc) tepkime sonucu oluşan ürünlerin derişiminin tepkimeye giren maddelerin derişimine bölünmesiyle hesaplanır. Denge sabiti Kc sadece sıcaklıkla değişir. Ayrıca Kc hesaplanırken sadece gazlar ve sulu çözeltideki maddeler ele alınır.
Homojen Denge ve Heterojen Denge Nedir?
Homojen Denge: Girenlerin ve ürünlerin aynı fazda olduğu denge tepkimeleridir.
Heterojen Denge: Girenlerin ve ürünlerin farklı fazlarda olduğu denge tepkimeleridir.
Denge Sabiti Kc Nelere Bağlıdır
Sadece sıcaklığa bağlıdır.
Endotermik tepkimelerde: Sıcaklık artışıyla Kc değeri artar.
Ekzotermik tepkimelerde: Sıcaklık artışıyla Kc değeri azalır.
Kp Nedir?
Kp kısmi basınçlar cinsinden denge sabitidir. Tepkime sonucu oluşan ürünlerin kısmi basıncının giren maddelerin kısmı basıncının çarpımına bölünmesiyle bulunur.
Yalancı Denge Sabiti (Q) Nedir?
Q=Kc ise reaksyon dengededir
Q>Kc ise reaksyon dengede değildir ve Q kendini küçültmek ister, denge girenlere kayar.
Q<Kc ise reaksyon dengede değildir ve Q kendini büyütmek ister, denge ürünlere kayar.
Kaydol:
Kayıtlar (Atom)



